Witam Kochani zaczynamy powtórki bądźcie wyrozumiali to mój pierwszy blog, ale coś czuję, że będzie to mega przygoda i wejdzie mi w krew. Startujemy...😊😊😊😊
Wiązania kowalencyjne
- Dublet elektronowy.
- Oktet elektronowy.
- Odczytywanie symboli i wzorów chemicznych.
O właściwościach pierwiastków decyduje liczba elektronów walencyjnych ich atomów. To bardzo ważna informacja, dlaczego? Dlatego, że atomy tych pierwiastków będą dążyły do takiej sytuacji aby uzupełnić elektrony ostatniej powłoki by uzyskać trwałą konfigurację. Czyli pojawia się nam:
- oktet czyli osiem elektronów
- dublet czyli dwa elektrony ale dotyczy to tylko atomu wodoru H
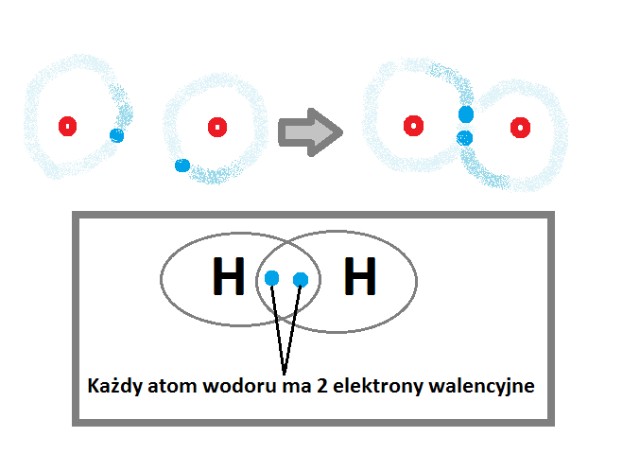 |
https://samequizy.pl/wiazanie-kowalencyjne/
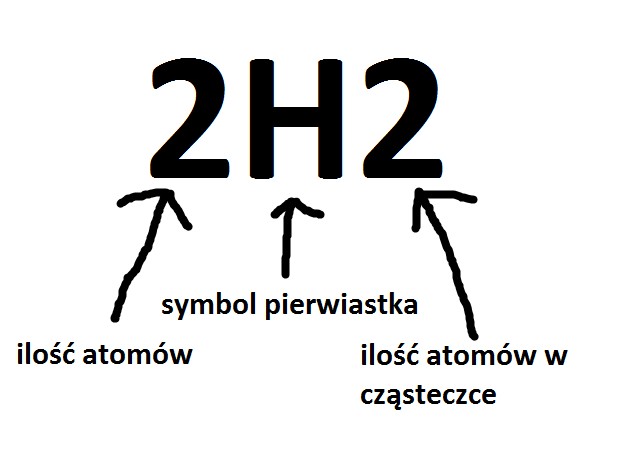
Pamiętajmy o bardzo ważnej rzeczy jak odczytywać symbole i wzory. Podam kilka przykładów:
- pierwiastki zapisujmy symbolami dlatego nieodłącznym kumplem jest Twój UKŁAD OKRESOWY . Prosty przykład: P - fosfor, Mn - mangan.
- do zapisu cząsteczek stosujemy wzory chemiczne a do tego zapisu znowu niezbędne są symbole pierwiastków. Pamiętajcie a powtarzam to z uporem maniaka😉 cząsteczki dzielimy na homotypowe (czyli takie same atomy pierwiastków tworzą cząsteczkę) i heterotypowe (czyli różne atomy pierwiastków - różne symbole). Do rzeczy podam przykłady a Wy analizujcie. H2 i HCl.
U góry są dwie grafiki także spójrzcie uważnie. Ważny link: https://epodreczniki.pl/a/wiazania-chemiczne---kowalencyjne-i-kowalencyjne-spolaryzowane/DZZ44URWd.
Przećwicz sam:
- Odczytaj z i zapisz z układu okresowego symbole pierwiastków: tlenu, azotu, siarki. Zastanów się do jakiej konfiguracji będą dążyły atomy tych pierwiastków do dubletu czy do oktetu.
- Zastanów się jakiego typu są to cząsteczki homo czy heterotypowe: N2, CO2, H2O, Cl2.
|

Komentarze
Prześlij komentarz